傳媒
港大與國際研究團隊發現 PARP-1 新的複合物可促進受損傷DNA的修復
為乳腺癌及卵巢癌標靶治療帶來新思路
2015年09月29日
過往大量研究顯示PARP-1在DNA損傷修復中扮演重要的角色,因此醫學界認為它是一種有價值的癌症治療藥物標靶,並投入大量資源進行研究。PARP-1是一種聚ADP核糖聚合酶, 結合受損的 DNA可啟動其酶活性, 結果導致其自身的聚ADP核糖化修飾進而招募下游多種蛋白來修復受損傷的DNA。自上世紀80年代發現抑制PARP-1酶活性可以阻止癌細胞受損的DNA的有效修復,從而提高化療療效,至今已有PARP抑制劑獲美國食品與藥物管理局(FDA)及歐洲藥物管理局(EMA)批准上市,用於含BRCA基因突變的女性卵巢癌的臨床治療。現階段PARP抑制劑的運作原理有幾種假設,其中之一稱為「合成致死」,即PARP抑制劑與化療或放療結合,能選擇性地抑制含BRCA基因突變的癌細胞修復受損的DNA,進而殺死癌細胞,對健康細胞則危害不大。目前醫學界尚未全面了解PARP抑制劑的運作機制,PARP抑制劑還存在著各種副作用,腫瘤也最終會產生抗藥性。
最近,香港大學李嘉誠醫學院與卡羅琳醫學院及香港科技大學的研究團隊合作,發現阻斷PARP-1與蛋白Timeless 的結合會阻礙DNA同源重組修復過程,但PARP抑制劑卻無法阻止PARP-1與Timeless結合。研究團隊同時發現PARP-1與Timeless的複合物可幫助DNA修復損傷。這些研究結果為進一步理解PARP抑制劑的運作機制提供了重要啟示,也為未來針對PARP-1標靶癌症療法的研究指出了一條新的思路。該研究已於9月份發表在《Molecular Cell》期刊網上版。
研究意義
研究人員之一、香港大學李嘉誠醫學院生物醫學學院助理教授錢程民博士表示:「是次研究發現阻斷PARP-1與Timeless的結合會阻礙受損DNA的修復,這一發現提供了新的研究思路,即是否能通過研發新的藥物來抑制PARP-1與Timeless結合,阻斷癌細胞受損DNA的修復過程,此項研究所提供的詳細結構資料對將來可能的藥物設計及篩選帶來了很大便利。」
研究方法及研究結果
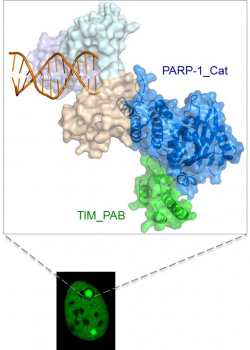
在本研究中,研究團隊首次發現 PARP-1能夠與蛋白Timeless形成複合物,並指出PARP-1與Timeless的結合不依賴於PARP-1的聚ADP核糖化修飾。運用X 光晶體學研究技術,研究團隊剖析出Timeless和PARP-1結合物的三維結構。利用活細胞成像技術和FRAP實驗,研究團隊進一步闡明了在細胞內PARP-1與Timeless的複合物會迅速被募集到DNA雙鏈損傷處,促進同源重組修復。Timeless到DNA損傷處進行修復需依賴它與PARP-1的結合,但卻不依賴PARP-1的酶活性。PARP-1與Timeless複合物的三維結構從運作機制上解釋了為何兩者的結合可不依賴於PARP-1的酶活性,也說明了為何現在臨床使用的PARP抑制劑無法阻斷兩者的結合。
過往研究
DNA作為細胞最基本卻最重要的組成部分之一,儲藏著生命的遺傳信息,並以自身作為藍本進行複製進而完成生命的傳延。維持基因組的完整和穩定性對於包括人類在內的所有物種的生存與繁衍都至關重要。但細胞卻時刻面臨威脅,包括紫外線照射、環境污染、體內活性氧自由基、細胞代謝過程產生的副產物、外界環境中的致癌因素在內的各種因素都可能導致DNA的損傷。若無法及時正確修復受損的DNA,可能對染色體造成永久傷害,導致多種疾病,如發育及神經系統功能缺陷、身體機能早衰及癌症。為了降低DNA損傷造成的破壞,細胞進化出多種損傷監控機制及修復途徑。不少研究已證實PARP-1與Timeless分別在多種DNA損傷檢控以及修復過程中有重要作用。 但迄今沒有研究表明PARP-1與Timeless可以以複合物的形式共同維護細胞基因組的完整及穩定。
有關研究團隊
此項合作研究由香港大學李嘉誠醫學院生物醫學學院助理教授錢程民博士的結構生物學研究小組聯同瑞典卡羅琳醫學院Thomas Helleday 教授以及香港科技大學潘逸才教授的團隊合作發表。錢程民博士的小組研究方向之一為了解DNA在複製過程中損傷及修復的分子機制,錢博士的研究主要由香港研究資助局優配研究金資助。合作團隊Thomas Helleday 教授以及潘逸才教授均為國際知名的癌症生物學家。
如欲瀏覽新聞圖片,請登入以下網址:
http://www.med.hku.hk/tc/news/