傳媒
港大化學系拆解活細胞中蛋白的相互作用網路為研發嚴重疾病治療提供新方向
2016年01月07日
細胞是生命的基本組成單元。其複雜的蛋白質互動網絡,可維持身體的正常操作及生命活動。細胞內蛋白質相互作用的不正常改變,可導致嚴重疾病如癌症及腦退化症等。由香港大學化學系助理教授李祥博士所帶領的研究小組,近日研發出一種嶄新的化學工具,用以剖析細胞內的蛋白質互動網絡。有關研究成果刊登於國際頂級期刊《自然—化學生物學》(Nature Chemical Biology)中,此為本港首個研究小組於該期刊所發表的原創研究文章。
蛋白質為細胞內主要的生物大分子,有著非常重要的角色,能影響細胞的過程、結構及功能。就如人類社會的工作岡位一樣,細胞內的工作岡位亦不能只靠單一蛋白質來完成所有工作,而是靠成千上萬不同的蛋白的互動形成網絡,好像蛋白世界的「交際網絡」一樣。蛋白交際網絡倘若出現問題,嚴重者可導致致命疾病如癌症等。因此,找出不同蛋白在蛋白網絡中的角色及其相互關係,是目前生物醫學研究中的一個重大挑戰,其研究結果將有助於硏發各種疾病的診斷及治療方法。
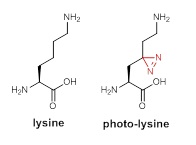
很可惜蛋白質並沒有使用臉書(Facebook)或推特(Twitter),要清楚明白蛋白質的交際網絡並不簡單。多年來,科研人員一直在尋找可靠的方法來剖析不同蛋白之間的關係。李博士及其研究小組想到可以派出一個「間諜」進入細胞,去監察裏邊蛋白之間的關係,於是他們合成了一個非天然胺基酸稱為光離胺酸(photo-lysine)。光離胺酸跟離胺酸(lysine)極為相似,而離胺酸是二十種必要胺基酸的其中一種。胺基酸是組成蛋白的基本結構單元,光離胺酸很容易騙過細胞蛋白合成機制,假裝成天然的離胺酸被用作蛋白的合成而不影響細胞的基本功能。重要的是這光離胺酸還帶著以紫外光能啟動的「間諜攝影機」¾雙吖丙啶(diaizirine),可「捕捉」每個跟特定蛋白互動的分子。
作為研究工具,光離胺酸可說簡便易用。李博士的團隊於論文中,闡述了只要將光離胺酸加入細胞培養基16小時,就足以讓細胞蛋白質被此「間諜」非天然氨基酸標籤。之後研究人員會將已標籤的細胞暴露於紫外線下數分鐘,去「捕捉」細胞中蛋白的相互作用。配備了以質譜為基礎的先進蛋白質組學方法,研究小組成功鑑定了許多已知和未為人發現的蛋白相互作用,它們對細胞過程調控如基因表達、信息傳遞和新陳代謝等尤其重要。有了這個嶄新的方法,科研人員現在可以剖析細胞中蛋白的相互作用網路,從而加深對各種疾病的理解,繼而提供研發疾病治療的新方向。
傳媒如有垂詢,可致電香港大學理學院高級傳訊經理陳詩迪女士(電話:3917-5286/ 6703-0212;電郵:cindycst@hku.hk)
相關文章
“Photo-lysine captures proteins that bind lysine post-translational modifications”
期刊 《自然—化學生物學》
網頁連結 http://www.nature.com/nchembio/journal/vaop/ncurrent/full/nchembio.1990.html
《自然—化學生物學》是國際頂尖的科學期刊,發表最出色的化學生物學原創研究。
李祥博士
有關李祥博士及其團隊的更多信息,可以參閱他的小組網頁:
http://www.chemistry.hku.hk/staff/xiangli/xiangli/index.html
圖片下載
http://www.scifac.hku.hk/news/media?page=1